近日,中國科學(xué)院南海海洋研究所熱帶海洋環(huán)境與島礁生態(tài)全國重點(diǎn)實(shí)驗(yàn)室、廣東省海洋藥物重點(diǎn)實(shí)驗(yàn)室科研人員在海洋鏈霉菌來源吲哚生物堿類和多環(huán)內(nèi)酰胺類活性次級代謝產(chǎn)物的生物合成機(jī)制解析方面取得新進(jìn)展,相關(guān)成果分別以“Genome mining reveals a carboxyl O-methyltransferase gatekeeping the biosynthetic divergence of tryptophan dimers”和“Deciphering the biosynthetic logic for C14 oxidative modifications of polycyclic tetramate macrolactams”為題發(fā)表在化學(xué)領(lǐng)域權(quán)威期刊Organic Letter(有機(jī)化學(xué)通訊)和Chinese Journal of Chemistry(中國化學(xué)),并均被選為封面文章。
海洋微生物在適應(yīng)高鹽、高壓、黑暗、低溫(或局部高溫)、寡營養(yǎng)等嚴(yán)酷的生存環(huán)境壓力下,進(jìn)化出了與之相適應(yīng)的生理生化特征或特殊的代謝途徑,因此可產(chǎn)生化學(xué)結(jié)構(gòu)復(fù)雜或生物活性獨(dú)特的次級代謝產(chǎn)物,對這些產(chǎn)物的生物合成機(jī)制進(jìn)行深入研究可為其結(jié)構(gòu)改造和綠色生物制造提供重要理論依據(jù)。
細(xì)菌來源色氨酸二聚體(TDs)是一類具有顯著生物活性的天然產(chǎn)物,其中midostaurin (商品名Rydapt?)已被FDA批準(zhǔn)用于治療白血病。研究團(tuán)隊(duì)前期從深海來源鏈霉菌Streptomyces marincola SCSIO 03032中發(fā)現(xiàn)了3類具有細(xì)胞毒活性的TDs (包括SPMs、LNMs和IDMs),克隆鑒定了參與TDs的生物合成基因簇(spm),證實(shí)spm為非典型基因簇,即在基因簇外存在游離的生物合成基因。近期,研究團(tuán)隊(duì)成功從菌株SCSIO 03032基因組中鑒定了一個(gè)游離在spm基因簇外的甲基轉(zhuǎn)移酶SpmM1,從其突變株中分離獲得了5個(gè)新穎的色氨酸二聚體IDMs,通過生化表征確定SpmM1負(fù)責(zé)催化LNMs中吡咯環(huán)側(cè)鏈羧基的氧甲基化,進(jìn)一步結(jié)合喂養(yǎng)實(shí)驗(yàn)證實(shí)SpmM1通過甲基化反應(yīng)控制SPMs和IDMs生物合成途徑的分化,且羧甲基為SPMs形成的特異識別位點(diǎn)。以上結(jié)果為鑒定其它游離在基因簇外的后修飾酶提供了研究思路。副研究員馬亮和博士劉智文為本文共同第一作者,研究員張長生為通訊作者。
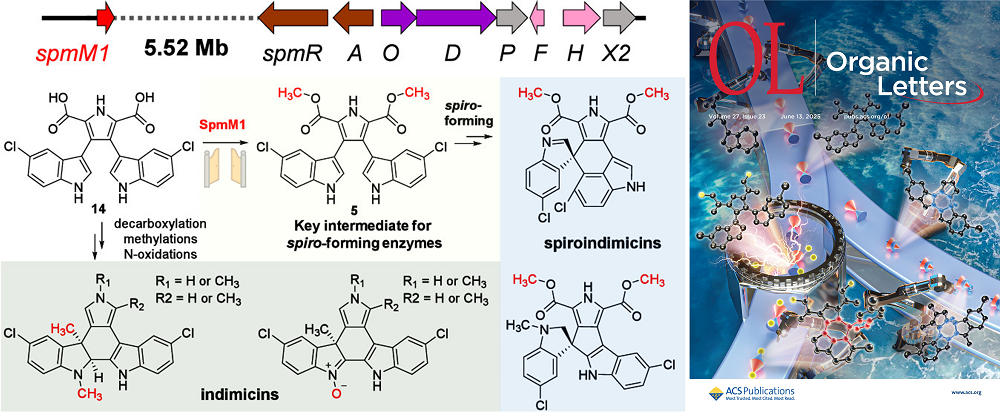
圖1?色氨酸二聚體生物合成途徑中游離甲基轉(zhuǎn)移酶SpmM1的功能研究
多環(huán)內(nèi)酰胺類天然產(chǎn)物(PoTeMs)具有復(fù)雜的化學(xué)結(jié)構(gòu)和良好的生物活性,是藥物先導(dǎo)化合物和生物農(nóng)藥的重要資源。PoTeMs的化學(xué)合成步驟多、收率低,但生物合成卻非常簡潔和保守,可通過途徑改造實(shí)現(xiàn)不同類型PoTeMs的綠色定制生產(chǎn)。遺憾的是,目前仍缺少高效、干凈的底盤宿主應(yīng)用于PoTeMs基因簇的異源表達(dá),且尚不清楚數(shù)量最多的5/5型和5/5/6型PoTeMs結(jié)構(gòu)中C14位氧化修飾差異的生物合成機(jī)制。研究團(tuán)隊(duì)通過大片段敲除改造海洋鏈霉菌Streptomyces sp. ZJ306,構(gòu)建了專屬生產(chǎn)PoTeMs多烯前體的干凈底盤細(xì)胞306A,為實(shí)現(xiàn)PoTeMs生物合成基因“即插即用”和藥源PoTeMs的結(jié)構(gòu)多樣化奠定了基礎(chǔ)。團(tuán)隊(duì)進(jìn)一步通過在底盤細(xì)胞306A中的組合生物合成比較研究表征了南海來源放線菌Streptomyces falvogriseus SCSIO 40032中沉默PoTeMs基因簇fla的生物合成途徑,通過喂養(yǎng)和同位素標(biāo)記實(shí)驗(yàn)證實(shí)黃素環(huán)化酶FlaB1在催化C6–C13環(huán)化的同時(shí)引入羥化和環(huán)氧化修飾,體外實(shí)驗(yàn)進(jìn)一步確定P450酶FlaD及其同源酶FtdF、SSHG_05717負(fù)責(zé)將5/5/6型PoTeMs中的C14位羥基轉(zhuǎn)化為酮基,同時(shí)催化后續(xù)的C12位羥化。基于以上結(jié)論,本研究成功揭示了5/5型和5/5/6型PoTeMs中C14位迭代氧化修飾的生物合成邏輯。2022級博士研究生蔣鵬為本文第一作者,研究員張長生與副研究員張麗萍為共同通訊作者。
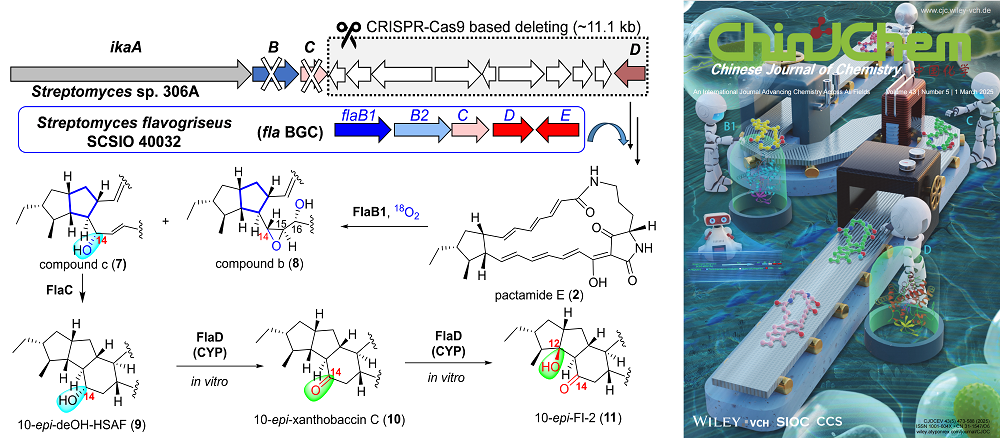
圖2?PoTeMs異源表達(dá)底盤細(xì)胞306A構(gòu)建及C14位迭代氧化機(jī)制解析
以上工作得到了國家重點(diǎn)研發(fā)計(jì)劃“合成生物學(xué)”重點(diǎn)專項(xiàng)、國家自然科學(xué)基金委重大項(xiàng)目、廣東省基礎(chǔ)與應(yīng)用基礎(chǔ)研究基金項(xiàng)目等資助。
論文信息:1、Liang Ma,# Zhiwen Liu,# Wenjun Zhang,Yiguang Zhu,Liping Zhang,Weiliang Xiong,Xiao-Nian Li,Xinpeng Tian,Changsheng Zhang.* Genome mining reveals a carboxyl O-methyltransferase gatekeeping the biosynthetic divergence of tryptophan dimers. Organic Letters,2025,27 (23):5936-5941.?
2、Peng Jiang,Hongbo Jin,Wenjun Zhang,Wei Tang,Xiaodong Jiang,Yiguang Zhu,Ying Wang,Liping Zhang,* and Changsheng Zhang.* Deciphering the biosynthetic logic for C14 oxidative modifications of polycyclic tetramate macrolactams. Chinese Journal of Chemistry,2025,43 (5):483-490. ?
論文鏈接:https://doi.org/10.1021/acs.orglett.5c01012
??????????https://doi.org/10.1002/cjoc.202400982
附件下載:


